成都动物所基于基因组和HIV-1感染转录组研究北平顶猴HIV-1 持续性感染的免疫调控机制
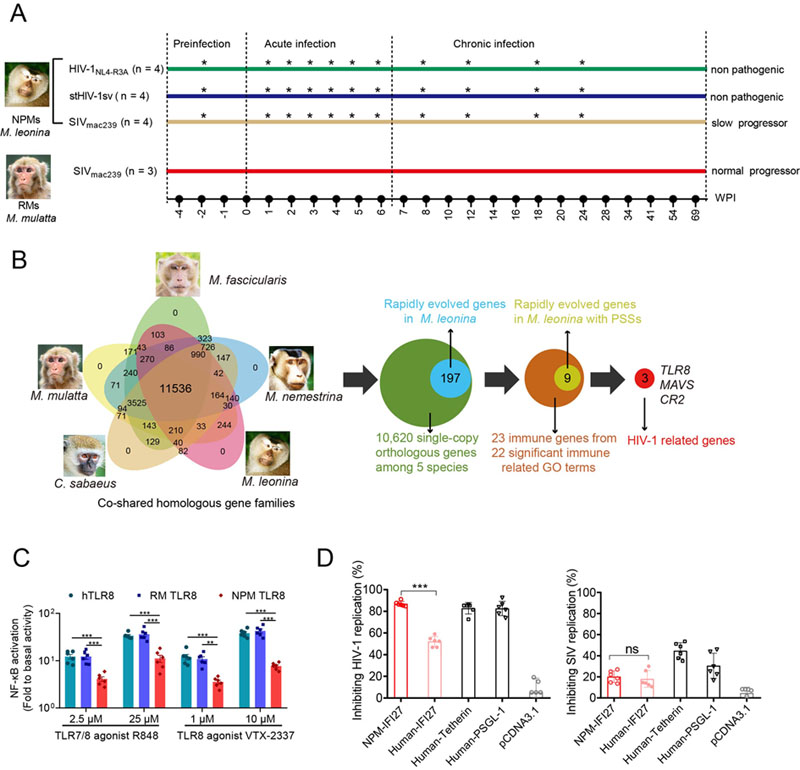
缺乏直接感染HIV-1的动物模型是制约艾滋病研究的关键瓶颈之一。平顶猴是目前报道唯一可感染HIV-1的旧大陆猴,国内分布的平顶猴物种为北平顶猴。在前期研究中,风暴平台成都动物研究所研究员郑永唐团队在国际上首次发现平顶猴宿主限制因子TRIM5ɑ与CypA发生融合,TRIMCyp蛋白丧失了限制HIV-1复制的功能,从而阐明了平顶猴易感HIV-1的分子机制。首次了建立HIV-1感染北平顶猴(Macaca leonina)艾滋病动物模型,发现HIV-1在北平顶猴体内呈现持续性低水平复制,宿主限制因子APOBEC3也诱导了HIV-1病毒的超突变,北平顶猴APOBEC3G异常剪切降低了其对HIV-1基因组编辑压力。转录因子ZNF683和干扰素IFN-α/γ可能是抑制HIV在北平顶猴体内复制及延缓发病的重要因素。从stHIV-1sv感染137周的北平顶猴体内分离出一株HIV-1 VpuG53D适应性突变体,发现该突变株体外感染性远强于原始株和其它时间点分离的病毒,VpuG53D获得了更强拮抗北平顶猴限制因子Tetherin的能力并显著增强了HIV-1子代病毒的释放。比较SIV感染北平顶猴和猕猴的病毒-免疫特征及病程进展,发现北平顶猴感染病毒后肠道完整性明显维持的更好,微生物易位水平更低,免疫活化水平低,SIV感染北平顶猴能维持更好的CD4+ T细胞稳态及减缓的疾病进展。相对SIV感染猕猴而言,HIV-1感染北平顶猴也表现出更低的免疫活化水平和更低的炎症反应。
为构建可直接感染HIV-1并发展为艾滋病的合适非人灵长类动物模型,郑永唐团队和成都动物所研究员吴东东团队合作,基于北平顶猴基因组和HIV-1感染后转录组,研究了北平顶猴HIV-1持续性感染的免疫调控机制。
研究团队首次对北平顶猴基因组测序,组装了北平顶猴的参考基因组,发现北平顶猴基因组全长2.85*109 bp,注释出编码23,570个蛋白。将北平顶猴与其它13种非人灵长类和人类比较,构建了北平顶猴系统进化树,发现北平顶猴与猕猴分歧时间为6.22百万年,与南平顶猴分歧时间为3.93百万年。因此,北平顶猴进化地位可能与其独特的免疫反应和病毒感染特征相关。推测在各种病原体与宿主之间漫长的协同进化过程中,免疫相关基因会受到正选择的作用,而这些正选择的基因可能会与HIV-1感染北平顶猴后的病毒-免疫特征相关。
研究团队将北平顶猴编码蛋白的所有基因与猕猴、南平顶猴、食蟹猴和非洲绿猴比较,从中选择在北平顶猴中受到正选择的基因,发现其中3个基因(TLR8、MAVS和CR2)与HIV-1复制密切相关。北平顶猴的TLR8与猕猴相比,有9个正选择位点突变的氨基酸,但北平顶猴的TLR8表达并未受影响,与人和猕猴相似。功能实验发现北平顶猴TLR8激活炎症反应的能力减弱,这可能是HIV-1感染北平顶猴后免疫活化低的原因之一。
研究团队对SIVmac239、HIV-1NL4-R3A、stHIV-1sv感染北平顶猴后连续时间点的外周血单个核细胞进行了转录组测序。整合基因组和转录组数据,筛选与HIV-1复制水平低下相关的候选基因。发现在HIV-1感染北平顶猴后上调的基因中,有一部分干扰素诱导基因(ISG)在感染1-2周迅速上调,其中IFI27基因上调最显著。北平顶猴的IFI27基因与人的同源基因相比发生大量突变。在体外过表达和敲低实验中,均发现北平顶猴IFI27可能是北平顶猴特异的HIV-1限制因子,可特异地抑制HIV-1复制,但不抑制SIV复制,这可能也是HIV-1在北平顶猴中低水平复制的机制之一。
以上研究首次基于基因组学和感染转录组学研究了北平顶猴HIV-1持续性感染的免疫调控机制,为构建合适的HIV-1非人灵长类动物模型提供了科学数据。近日,相关研究论文以Genomic evidence for the nonpathogenic state in HIV-1-infected northern pig-tailed macaques为题,在线发表于Molecular Biology and Evolution。成都动物所副研究员庞伟、博士研究生路莹、何文强,副研究员邵永及博士研究生庄晓琳为文章的共同第一作者,郑永唐和吴东东为文章的共同通讯作者。以上研究得到NSFC-四川联合基金、国家重点研发专项等项目资助。
基于基因组学和感染转录组学研究了北平顶猴HIV-1持续性感染的免疫调控机制
A)病毒感染动物69周内,HIV-1感染北平顶猴致病不明显,SIV感染北平顶猴致病进程较慢,而SIV感染猕猴致病进程较快。B)比较基因组发现与HIV-1感染相关的北平顶猴基因。 C)北平顶猴TLR8激活炎症反应的能力减弱。D)北平顶猴IFI27特异地抑制HIV-1复制但不抑制SIV复制。